Una mirada a los Dispositivos Médicos: Conoce las características de las etiquetas y contraetiquetas
- Detalles
- Escrito por: Editor
- Visitas: 1367

Si alguna vez te has preguntado qué es una etiqueta y a qué se le conoce como contraetiqueta, así como los requisitos que deben cumplir, este artículo de nuestro blog es perfecto para ti.
En este blog te guiaremos para que conozcas y refuerces esta información, además de familiarizarte con el marco regulatorio que establece las características que deben tener las etiquetas y contraetiquetas.
Para empezar, es importante que comprendamos lo que indica la fracción II del artículo 179 del Reglamento de Insumos para la Salud (RIS) y la NOM-137-SSA1-2008.
En el artículo 179 del RIS se enumeran los requisitos para obtener el Registro Sanitario de un Dispositivo Médico (DM). El numeral II establece como requisito el proyecto de etiqueta en idioma español. Además, en este mismo artículo se menciona que dicha etiqueta debe cumplir con los términos de la Norma correspondiente, es decir, la NOM-137-SSA1-2008.
La NOM 137-SSA1 establece los requisitos mínimos que se deben cumplir para comunicar la información a los usuarios en el etiquetado de los dispositivos médicos, ya sean de origen nacional o extranjero, que se comercialicen o se destinen a usuarios en el territorio nacional. Esto incluye equipos médicos, prótesis, órtesis, ayudas funcionales, agentes de diagnóstico, insumos de uso odontológico, materiales quirúrgicos, de curación y productos higiénicos.
Las etiquetas permiten comunicar información a los usuarios, y según la definición de la NOM-137-SSA1-2008, se refieren a cualquier marbete, rótulo, inscripción, marca o imagen gráfica que se haya escrito, impreso, estarcido, marcado, marcado en relieve o en huecograbado, adherido o precintado en cualquier material que pueda contener el dispositivo médico, incluyendo el envase mismo.
A diferencia de la etiqueta, la contraetiqueta contiene información complementaria o total mínima obligatoria sanitaria y comercial cuando la etiqueta original no cumple parcial o totalmente con la NOM-137-SSA1-2008.
Ahora que hemos cubierto el marco regulatorio y las definiciones, es hora de revisar la parte más práctica de los requisitos que debemos cumplir para evitar observaciones por parte de la Autoridad Sanitaria.
La respuesta no es tan sencilla, ya que depende en gran medida de la clase, categoría y características particulares de nuestro DM. Sin embargo, en términos generales, las etiquetas de los DM deben cumplir con lo siguiente:
- Deben proporcionar información completa o complementaria (contraetiqueta) en idioma español, de acuerdo con los términos de la NOM 137-SSA1. Esto incluye, entre otros:
- Denominación genérica.
- Denominación distintiva.
- Datos del fabricante.
- País de origen.
- Número de registro.
- Número de lote o número de serie.
- Contenido.
- Instrucciones de uso.
- Información sobre cualquier incidente adverso que pueda ocurrir debido al uso del producto.
- Leyendas de advertencia o precaución, en caso de ser necesarias
- Para productos estériles, se deben incluir las siguientes leyendas o símbolos:
- "Producto estéril".
- "No se garantiza la esterilidad del producto en caso de que el empaque primario tenga señales de haber sufrido ruptura previa".
- "Esterilizado con óxido de etileno".
- "Esterilizado con radiación gamma".
- "Esterilizado con calor seco o húmedo".
- "Procesados usando técnicas asépticas" u otras análogas.
- En caso aplicable, incluir "Atóxico", "libre de pirógenos" u otras leyendas alusivas.
- Los productos de un solo uso deben llevar las leyendas o símbolos:
- "Desechable".
- "Usar solamente una vez" u otras análogas.
- Los dispositivos médicos estériles reutilizables deben indicar la metodología para su re-esterilización.
- Los símbolos para unidades de medida deben seguir las unidades del Sistema General de Unidades de Medida.
- Para dispositivos formulados:
- Incluir la fórmula cualitativa o la declaración de sus principios activos o fármacos contenidos, cuando aplique.
- Para agentes de diagnóstico, incluir la leyenda:
- "Agente de diagnóstico" y, si corresponde, "Para uso exclusivo en Laboratorios Clínicos o de Gabinetes".
- Se pueden utilizar opcionalmente los símbolos incluidos en los apéndices normativos A e informativo B de la NOM-137-SSA-2008.
- En caso de ser aplicable, la etiqueta o contraetiqueta debe incluir la información señalada en las normas vigentes específicas del producto o las monografías farmacopeicas correspondientes.
- El proyecto de etiqueta se entrega en un solo ejemplar y en archivo WORD, y debe incluir el listado de presentaciones con la descripción y el número de código o catálogo de cada presentación del dispositivo médico, cuando sea necesario.
Como conclusión podemos decir que tanto la etiqueta como la contraetiqueta desempeñan un papel crucial en la comercialización de los DM. Mientras que la etiqueta original proporciona la información básica requerida, la contraetiqueta actúa como un respaldo, asegurándose de que ningún detalle importante quede fuera. Juntas, estas dos piezas conforman un conjunto completo de datos necesarios para la venta y uso adecuado de los DM.
Nos encantaría escuchar tu opinión sobre este tema y si hay algún otro tema relacionado con la Regulación Sanitaria que te gustaría que abordáramos en futuros artículos.
Si tienes alguna duda sobre este tema o necesitas ayuda con algún trámite ante COFEPRIS, no dudes en contactarnos al número 55 6173 2592. Estamos aquí para ayudarte con tu proyecto.
Escribir comentario (1 Comentario)- Detalles
- Escrito por: Editor
- Visitas: 630
En nuestro blog del 18 de mayo de 2022, hemos tocado el tema de marco regulatorio de los Suplementos Alimenticios, y ahora corresponde hablar sobre su Publicidad.
La publicidad de los Suplementos Alimenticios es un tema sumamente importante, ya que hoy en día se les atribuyen muchas propiedades que pueden resultar engañosas y causar daño a la salud de la población, por ello, nuestra Autoridad Sanitaria mantiene la publicidad estrictamente controlada y pide contar con permiso de publicidad para poder publicitar nuestros suplementos alimenticios.
Para poder obtener el permiso de publicidad es necesario que conozcamos a detalle las leyendas y declaraciones que pueden incluirse y lo que no puede incluirse en los anuncios publicitarios.
A continuación, te dejamos a detalle lo indicado en el Reglamento de la Ley General de Salud en Materia de Publicidad en donde se da una guía para elaborar nuestra publicidad de tal manera que sea orientadora y educativa respecto al Suplemento Alimenticio del cual se trate.
- Debe ser congruente con sus características o especificaciones autorizadas.
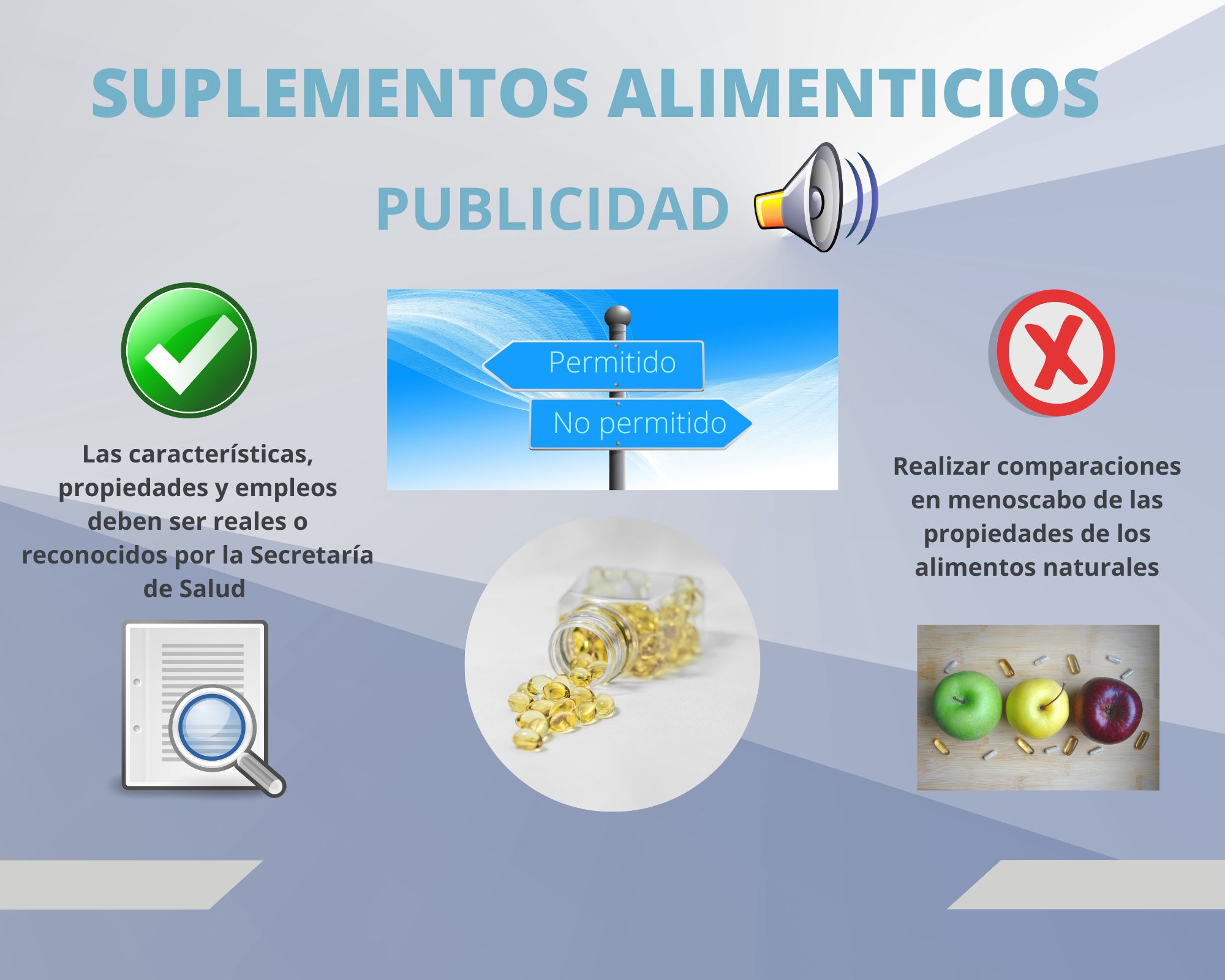
- Las características, propiedades y empleos deben ser reales o reconocidos por la Secretaría
- Deben estar en idioma español, en términos claros y fácilmente comprensibles para el público a quien va dirigida.
- Proporcionar información sanitaria sobre el consumo, el cual deberá corresponder, en su caso, a las finalidades señaladas en la autorización respectiva.
- Señalar las precauciones necesarias cuando el consumo pueda causar riesgo o daño a la salud de las personas.
- Contener información sobre las especificaciones para el uso adecuado, así como de los daños que pudieran ocasionar a la salud e incorporar una imagen gráfica del producto para evitar un error del consumidor.
- Estar impresas en colores contrastantes y en los tamaños señalados en el Reglamento.
- Estar redactadas en formas literarias positivas, cuando se trate de dar instrucciones para el consumo.
- Estar redactadas en formas literarias negativas cuando se trate de prevenir al consumidor sobre los riesgos que pueda representar.
Por otro lado, no está permitido que la publicidad de los Suplementos Alimenticios indique lo siguiente, ya que pueden representar un riesgo a la salud de la población:
- Desvirtuar o contravenir las disposiciones en materia de educación nutricional, higiénica y de salud establecida por la Secretaria de Salud.
- Indicar o inducir a creer explícita o implícitamente que el producto cuenta con los ingredientes o las propiedades de los cuales carezca.
- Establecer comparaciones entre productos cuyos ingredientes sean diferentes, cuando por ello se puedan generar riesgos o daños a la salud.
- Presentar como estimulantes o modificadores del estado físico o mental de las personas, excepto aquellos casos que así hayan sido reconocidos por la Secretaría.
- Inducir o promover hábitos de alimentación nocivos para la salud.
- Afirmar que el producto llena por sí solo los requerimientos nutricionales del ser humano.
- Atribuir a los alimentos industrializados un valor nutritivo superior o distinto al que tengan.
- Realizar comparaciones en menoscabo de las propiedades de los alimentos naturales.
- Expresar o sugerir, a través de personajes reales o ficticios, que la ingestión de estos productos proporciona a las personas características o habilidades extraordinarias.
- Declarar propiedades que no puedan comprobarse, o que los productos son útiles para prevenir, aliviar, tratar o curar una enfermedad, trastorno o estado fisiológico.
- No asociar con bebidas alcohólicas y tabaco.
- Los que se ostentan como medios para disminuir el consumo de nutrimentos no podrá mencionarlos como dietéticos y se establecerán los mensajes precautorios respecto de los posibles efectos que su consumo pudiera originar.
- No deberán emplearse denominaciones, figuras y declaraciones relacionadas con enfermedades, síntomas, síndromes, datos anatómicos, fenómenos fisiológicos.
Por último, cuando se haga publicidad de los suplementos alimenticios se deberá incluir la leyenda que en la autorización de la publicidad determine la Secretaría con base en los riesgos para la salud que el producto represente.
Como pudimos ver el Control Sanitario de la Publicidad de los Suplementos Alimenticios está bien definida y es nuestro deber cumplirla para evitar riesgos en la salud de la población que depende mucho de lo que se les hace llegar a través de los anuncios publicitarios.
Si tienes alguna duda sobre este tema o sobre la solicitud de algún trámite ante COFEPRIS contáctanos al número 55 6167 7092, podemos ayudarte con tu proyecto.
Danos tu opinión sobre este tema abordado en nuestro blog y compártenos si tienes algún tema en Regulación Sanitaria que quieras que revisemos en la siguiente emisión.
Escribir comentario (0 Comentarios)- Detalles
- Escrito por: Editor
- Visitas: 346

Como sabemos en un dossier de Dispositivos Médicos (DM) ya sea para el trámite de Registro Sanitario Nuevo, Modificación a las Condiciones del Registro Sanitario o Prórroga del Registro Sanitario, se requiere que presentemos ante la Autoridad documentos legales que en muchas ocasiones no conocemos del todo o bien algunas veces nos pueden proporcionar algún documento que no cumpla con lo establecido en nuestra regulación sanitaria actual, por lo que es importante conocer más sobre estos, pero antes de entrar en detalle es necesario que sepamos ¿qué es un documento legal o a qué se le considera un documento legal?, para posteriormente saber cuáles son los diferentes tipos de documentos legales que nos podemos encontrar en un trámite y sus principales características, para así saber si el documento legal es el adecuado o no dependiendo del tipo de trámite que se desee realizar, por lo que en este blog te explicaremos estos tópicos de una manera fácil y sencilla y esperamos que esta información te sea de utilidad para tu trabajo en el área Regulatoria.
Definición
Documentos Legales: Todo el conjunto de escritos públicos que acreditan fehacientemente todo tipo de hechos o actos confiriéndoles el carácter de auténticos. Por lo tanto, este tipo de documentos sirven para testimoniar de forma probatoria en un sentido amplio. Su característica fundamental es que debe ser aceptado legítimamente por los individuos intervinientes en el acto que este establezca, detalle o determine.
Resumiendo, podríamos decir que estos documentos surgen como consecuencia de la mutua aceptación de un hecho o acto.
Para que los documentos legales sean válidos y legítimos, deben estar presentes dos características distintivas: deben estar firmados por las personas intervinientes y contar con el correspondiente sello que certifique la autenticidad. Además, para que sea un documento oficial, un funcionario gubernamental debidamente designado y autorizado, debe avalar la legitimidad del mismo.
Ahora que ya conoces que es un documento legal, también es necesario que conozcas qué tipos de documentos se consideran como legales en un trámite de DM así como sus características principales, tanto de fabricación nacional como de fabricación extranjera de acuerdo a la legislación sanitaria actual:
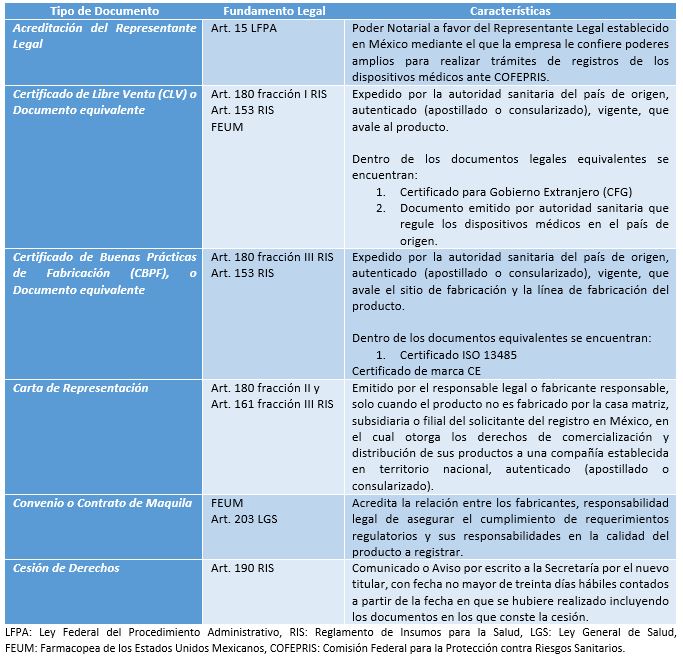
Tipos de Documentos Legales de Fabricación Nacional y sus Características
Tipos de Documentos Legales de Fabricación Extranjera y sus Características
Los documentos legales listados en las tablas anteriores son los más comunes, sin embargo, en algunos casos para los trámites de modificaciones a las condiciones del registro sanitario, se requieren incluir algunos otros documentos legales, los cuales dependerán del tipo y alcance de cada modificación, por mencionar alguna, en la modificación por cambio de razón social del fabricante se requiere incluir un documento que avale ese cambio de Razón Social.
Si tienes alguna duda sobre este tema o sobre la solicitud de algún trámite ante COFEPRIS contáctanos al número 55 6167 7092, podemos ayudarte con tu proyecto.
Danos tu opinión sobre este tema abordado en nuestro blog y compártenos si tienes algún tema en Regulación Sanitaria que quieras que revisemos en la siguiente emisión.
Escribir comentario (1 Comentario)